年终盘点:靶向 NSCLC 中的 ALK 重排
非小细胞肺癌 (NSCLC) 中的间变性淋巴瘤激酶 (ALK) 改变可以用多种 ALK 靶向药物有效治疗。第一代ALK抑制剂克唑替尼在无进展生存期(PFS)的延长上优于化疗,获批后,塞瑞替尼、阿来替尼、布格替尼、恩沙替尼等新一代ALK抑制剂相继问世。最近,一种强效的第三代 ALK 抑制剂劳拉替尼已获得FDA的批准,用于 ALK 阳性 (ALK+) NSCLC 的一线治疗。这些药物具有可控的毒性特征。然而,对 ALK 抑制剂的反应通常不持久,并且获得性耐药可能会作为在靶或脱靶改变的形式发生。靶向ALK抑制剂正在研究以探索耐药机制和超越进展的最佳治疗方案,并努力开发更新一代的 ALK 抑制剂。
一、ALK+ NSCLC
患者的特征
NSCLC 约占肺癌的 80%,其中 ALK+ NSCLC 占 3%–7%。ALK 是一种原癌基因,它编码主要在神经系统中表达的间变性淋巴瘤激酶。ALK 信号在癌细胞中主要通过三种机制被激活:基因融合、基因扩增和激活点突变。
ALK+ NSCLC 患者往往更年轻,没有吸烟史,并且腺癌是最常见的组织学亚型。最近的一项荟萃分析证实,与非 ALK+ 患者相比,ALK+ NSCLC 患者的血栓栓塞发生率增加。真实世界的数据还表明 ALK 重排 NSCLC 患者静脉血栓栓塞的风险增加。
二、NSCLC 中的 ALK 靶向治疗
目前批准用于晚期 ALK+ NSCLC 的六种 ALK TKI 分为三代。药物靶点、FDA 批准的适应症、试验设计和临床试验的主要终点总结如下。


第一代 ALK TKI
1. 克唑替尼(crizotinib)
克唑替尼是一流的第一代 ALK TKI,其开发彻底改变了 ALK+ NSCLC 的治疗。克唑替尼是受体酪氨酸激酶 ALK、ROS1 和 c-MET 的小分子抑制剂。在 I 期和 II 期研究中,克唑替尼在晚期 ALK 阳性 NSCLC 患者中表现出持久的反应导致 FDA 在 2016 年加速批准。在 III 期研究 PROFILE 1007 中,与化疗相比,克唑替尼首先显示出 PFS 改善一线和以前接受过治疗的患者。

然而,克唑替尼的药代动力学失败主要是由于其血脑屏障渗透性差,而 CNS 是克唑替尼的常见进展部位 。接受克唑替尼治疗的患者实际上会产生获得性耐药性。L1196M、G1269A 和 C1156Y 突变会改变 ATP 结合口袋的结构,从而阻止克唑替尼与 ALK 结合。
第二代 ALK TKI
第二代 ALK-TKIs 阿来替尼、塞瑞替尼、恩沙替尼和布格替尼是为克服克唑替尼耐药而开发的,它们对克唑替尼耐药的 ALK+ NSCLC 患者表现出强大的活性。
1.阿来替尼(alectinib)
阿来替尼是一种对 ALK 具有高度选择性的下一代抑制剂。与克唑替尼相比,阿来替尼不是 P-糖蛋白底物,对血脑屏障的渗透性更好。基于两项单臂试验(NP28761 和 NP28673),阿来替尼于 2015 年被 FDA 批准用于二线治疗,其中包括 225 名每天两次口服阿来替尼 600 mg 的患者。J-ALEX 试验是第一项表明第二代 ALK 抑制剂阿来替尼具有 PFS 优势并且比每天两次 300 毫克剂量的克唑替尼更耐受的研究。基于阿来替尼 600 mg 每天两次的 III 期 ALEX 试验,阿来替尼于 2017 年被 FDA 批准用于 ALK+ NSCLC 的一线治疗。

在 J-ALEX 研究的最终分析中,与克唑替尼相比,阿来替尼没有实现总生存 (OS) 获益,这反映出交叉到一线后治疗可能会极大地影响 OS,尤其是在 ALK+ NSCLC 中可以从所有 ALK TKI 中获得显着益处。一项前瞻性真实世界研究调查了在初始克唑替尼未出现疾病进展的 ALK+ NSCLC 患者中改用阿来替尼的策略【1】。结果表明,尽早从克唑替尼转换为阿来替尼可能是一个可行的选择,并可能促进更好的治疗依从性。
2.布格替尼(brigatinib)
布格替尼已被证明可以克服对第一代和第二代ALK TKI的耐药性。在接受过克唑替尼治疗(ALTA 试验)和未接受过克唑替尼治疗(ALTA-1L 试验)的 ALK+ NSCLC 患者中,布格替尼显示出有前途的抗肿瘤活性,包括对中枢神经系统 (CNS) 转移的显着活性【2】。

布格替尼在克唑替尼难治性ALK阳性 NSCLC 中的颅内疗效和最佳靶病灶反应
在 ALTA-1L 的最终分析中,无论 ALK 融合变体或 TP53 突变状态如何,布格替尼都显示出优于克唑替尼的疗效,尤其是在基线脑转移患者中。在一项网络荟萃分析中,与阿来替尼相比,布格替尼在 CNS 转移亚组中的疗效排名最高,而阿来替尼在总人群中的疗效排名最高【3】。

ALK抑制剂在无进展生存期(疗效)和 G3–5AAE(安全性)方面对总体患者人群的疗效和安全性的累积排序 (SUCRA) 值下的表面散点图。ALC,阿来替尼;CRZ,克唑替尼;BRG,布格替尼
一般来说,布格替尼的耐受性良好;然而,早发性肺毒性引起了一些担忧。ATOMIC ARI-AT-002 试验 ( NCT02706626 ) 正在进行,以评估 ALK+ NSCLC 患者在第二代 ALK 抑制剂治疗后布格替尼对 ALK 耐药突变的疗效。一项在一线 ALK+ NSCLC 中比较布格替尼与阿来替尼的III 期 ALTA-3 试验 ( NCT03596866 ) 也在进行中 。
3. 塞瑞替尼(ceritinib)
塞瑞替尼于2014 年获得 FDA 批准用于治疗进展或对克唑替尼不耐受的 ALK 阳性患者,并于2017 年作为一线治疗药物。批准基于ASCEND-1和 ASCEND-2 研究。
在 II 期 ASCEND-2 研究中,经过克唑替尼预处理的 ALK+ NSCLC 接受标准剂量 750 mg 每天的塞瑞替尼治疗,客观缓解率 (ORR) 达到 38.6%。一项 I 期三臂 ASCEND-8 研究表明,与空腹服用 750 毫克相比,塞瑞替尼450 毫克饭后显示出相似的疗效和更低的胃肠道毒性。
两项随机 III 期试验比较了塞瑞替尼与一线标准化疗 (ASCEND-4) 或二线 (ASCEND-5) 疗效。然而,ASCEND-4 和 ASCEND-5 中塞瑞替尼的毒性特征表明,与化疗相比,由于不良事件 (AE) 而导致的剂量中断和调整频率更高。在 ALK+ NSCLC 中比较塞瑞替尼与阿来替尼的真实世界数据发现,在 ALK+ NSCLC 中,与塞瑞替尼相比,阿来替尼暴露与更长的 OS 相关 [4]。

来自 ASCEND-8 研究的药代动力学 (PK) 数据使 FDA 批准塞瑞替尼 450 mg QD,与食物一起服用。
4. 恩沙替尼(ensartinib)
恩沙替尼是一种基于氨基哒嗪的小分子,可抑制 ALK。2020年获得中国国家药品监督管理局 (NMPA) 批准在国内上市,用于此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。
比较恩沙替尼与克唑替尼一线治疗 ALK+ NSCLC 的 III 期 eXalt3 研究数据显示,恩沙替尼组和克唑替尼组中位无进展生存(PFS)分别为25.8和12.7月(HR 0.51,95%CI 0.35-0.72)。颅内应答率方面来看,恩沙替尼也是碾压克唑,两组脑转移患者ORR分别为64%和21%。

第三代 ALK TKI
1.劳拉替尼 (lorlatinib)
劳拉替尼是第 3代 ALK TKI,是一种小而紧凑的大环抑制剂。在序贯 ALK-TKI 治疗后,在劳拉替尼耐药细胞或患者样本中发现了多种复合 ALK 突变。劳拉替尼可以抑制 G1202R 突变,但不能抑制复合突变 。劳拉替尼于 2018 年被 FDA 批准用于 ALK+ NSCLC 的二线或三线治疗。
比较劳拉替尼与克唑替尼的 III 期 CROWN 研究实现了 HR 0.28 的同类最佳差异 PFS 获益,基于此在 2021 年 3 月获得 FDA 的一线批准。通过盲法独立中央审查评估的确认客观反应的患者百分比,劳拉替尼明显高于克唑替尼(76% [95% CI,68 至 83] 对 58% [95% CI,49 至 66])。在基线时有可测量的 CNS 转移的 30 名患者中,劳拉替尼组 82%(95% CI,57 至 96)和克唑替尼组 23%(95% CI,5 至 54)有颅内反应。

意向治疗人群和基线脑转移患者的客观反应。
三、正在研究的第四代 ALK TKI
顺序使用对 ALK“单突变体”有活性的 ALK TKI 将导致双 ALK 耐药突变。已开发出TPX-0131、NVL-655等第四代ALK TKI,具有“双突变活性”。
TPX-0131 是一种紧凑型大环抑制剂,其设计完全适合 ATP 结合口袋。它可以降低对各种 ALK TKI 耐药突变的易感性. TPX-0131除了对大多数单一耐药突变敏感外,对G1202R+L1198F、G1202R+L1196M、L1196M+L1198F、G1202R+C1156F等复合突变也有效。
另一种第 4 代 ALK TKI,NVL-655,是一种脑渗透性小分子抑制剂,具有抗溶剂前沿耐药突变的活性,如 G1202R、G1202R+L1196M 和 G1202R+G1269A 。此外,NVL-655 显示出脑外显率,以开辟治疗脑转移的潜力,同时避免脱靶 CNS 不良事件。
四、如何选择最佳的一线治疗?
与非致癌基因驱动的 NSCLC 亚型相比,ALK+ NSCLC 具有更高的脑转移倾向。与第一代ALK TKI相比,第二代和第三代ALK TKI对脑转移的疗效更佳。塞瑞替尼在 ALK-TKI 初治和预处理患者中的颅内 ORR 为 35%–73%,颅内疾病控制率 (DCR) 为 61%–86% 。阿来替尼在临床试验中的颅内 ORR 和颅内 DCR 分别为 54%–81% 和 78%–90% 。布格替尼 在 CNS 中表现出令人鼓舞的活性,颅内 ORR 为 42%–73%,颅内 DCR 为 83%–93% 。
一项荟萃分析调查了 ALK TKI 在治疗脑转移的 ALK+ NSCLC 患者中的作用,这些患者接受过或未接受过放疗和/或化疗 【5】。结果证实,与克唑替尼相比,第二代 ALK TKI(阿来替尼、布格替尼和塞瑞替尼)的颅内控制效果更好。
恩沙替尼的颅内 ORR 为 63.6%–70%,颅内 DCR 为 98%–100% 。劳拉替尼在一线治疗中的颅内 ORR 为 61%–66% 。劳拉替尼在第二代 ALK TKI 预处理的患者中也显示出显着的颅内活性,有或没有基线 CNS 转移 。该证据表明,对无症状脑转移患者停止脑放疗并在进展期间使用放疗可能是一种选择。有必要进行前瞻性试验以确认该策略的有效性。

ALK+ NSCLC 的治疗策略。
五、结论
ALK+ NSCLC的治疗算法正变得越来越复杂。新一代 TKI 具有更好的 CNS 穿透血脑屏障的能力,从而提高颅内反应率并预防脑转移。仍然缺乏所有 ALK TKI 之间的直接比较,当前克服开发更有效药物的挑战对于提高 ALK+ NSCLC 的未来存活率至关重要。
参考文献:
1. Pan Y, Xiao W, Ye F, Wang H, Shen Y, Yu X, Han X, Chu Q, Zhou C, Zhang Z, Ren S. Outcomes of switching from crizotinib to alectinib in patients with advanced non-small cell lung cancer with anaplastic lymphoma kinase fusion. Ann Transl Med. 2021 Jun;9(12):1014. doi: 10.21037/atm-21-2769. PMID: 34277814; PMCID: PMC8267309.
2. Huber RM, Hansen KH, Paz-Ares Rodríguez L, West HL, Reckamp KL, Leighl NB, Tiseo M, Smit EF, Kim DW, Gettinger SN, Hochmair MJ, Kim SW, Langer CJ, Ahn MJ, Kim ES, Kerstein D, Groen HJM, Camidge DR. Brigatinib in Crizotinib-Refractory ALK+ NSCLC: 2-Year Follow-up on Systemic and Intracranial Outcomes in the Phase 2 ALTA Trial. J Thorac Oncol. 2020 Mar;15(3):404-415. doi: 10.1016/j.jtho.2019.11.004. Epub 2019 Nov 19. PMID: 31756496.
3. Ando K, Akimoto K, Sato H, Manabe R, Kishino Y, Homma T, Kusumoto S, Yamaoka T, Tanaka A, Ohmori T, Sagara H. Brigatinib and Alectinib for ALK Rearrangement-Positive Advanced Non-Small Cell Lung Cancer With or Without Central Nervous System Metastasis: A Systematic Review and Network Meta-Analysis. Cancers (Basel). 2020 Apr 10;12(4):942. doi: 10.3390/cancers12040942. PMID: 32290309; PMCID: PMC7226463.
4. Wilkinson S, Gupta A, Scheuer N, et al. Assessment of Alectinib vs Ceritinib in ALK-Positive Non–Small Cell Lung Cancer in Phase 2 Trials and in Real-world Data. JAMA Netw Open. 2021;4(10):e2126306. doi:10.1001/jamanetworkopen.2021.26306
5. Petrelli F, Lazzari C, Ardito R, Borgonovo K, Bulotta A, Conti B, Cabiddu M, Capitanio JF, Brighenti M, Ghilardi M, Gianni L, Barni S, Gregorc V. Efficacy of ALK inhibitors on NSCLC brain metastases: A systematic review and pooled analysis of 21 studies. PLoS One. 2018 Jul 27;13(7):e0201425. doi: 10.1371/journal.pone.0201425. PMID: 30052658; PMCID: PMC6063430.
6. Peng L, Zhu L, Sun Y, Stebbing J, Selvaggi G, Zhang Y, Yu Z. Targeting ALK Rearrangements in NSCLC: Current State of the Art. Front Oncol. 2022 Apr 6;12:863461. doi: 10.3389/fonc.2022.863461. PMID: 35463328; PMCID: PMC9020874.
- 上一篇
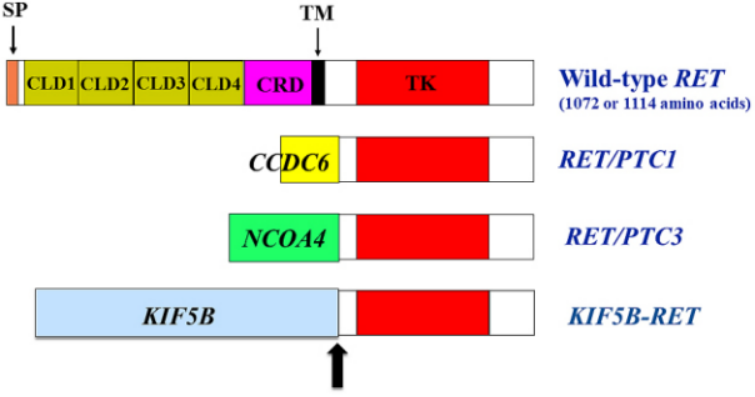
2022年终盘点 | NSCLC靶向治疗之RET篇
RET基因是一种重要的癌驱动基因,主要通过突变、过度表达等方式影响多种肿瘤的发生、发展及转移。当染色体重排导致RET基因中间断裂后,RET基因3'端激酶结构域会与不同的基因发生融合,形成驱动肿瘤增殖的融合基因。迄今为止,RET与其他伴侣基因的融合已在多种人类癌症中报道,包括甲状腺状癌和非小细胞肺癌。 在甲状腺状癌(PTC)和非小细胞肺癌(NSCLC)中检测
- 下一篇
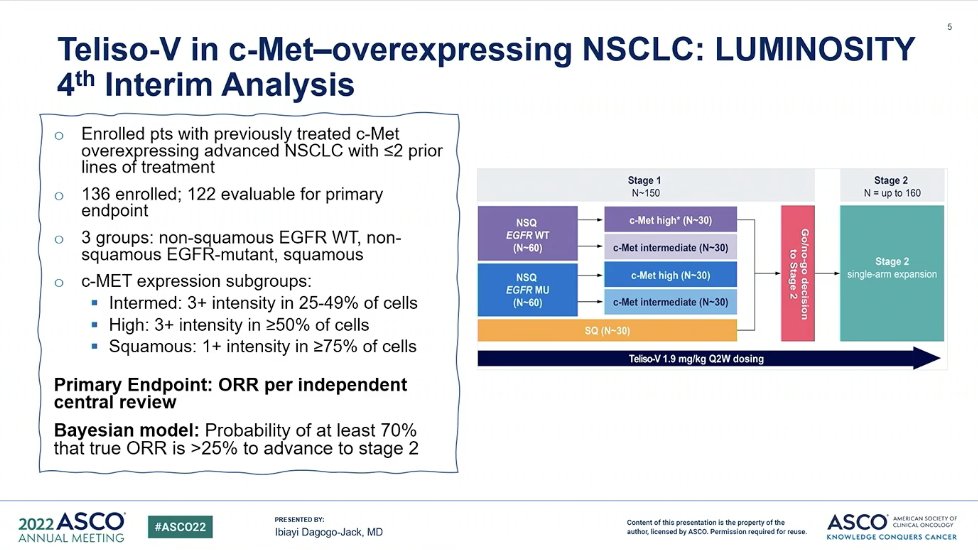
Telistuzumab Vedotin在c-Met过表达的NSCLC中展示出一定的前景
尽管在治疗方面有所进步,但肺癌仍是全球男性和女性癌症相关死亡的主要原因。大约85%的肺癌都归类为非小细胞肺癌(NSCLC)。经过标准护理治疗(包括既往的铂基化疗)后病情进展的患者,治疗选择有限,预后较差。 2022年1月4日,艾伯维公司宣布,美国食品和药物管理局(FDA)授予telisotuzumab vedotin (Teliso-V)突破性治疗资格(BT

